Reclassification moléculaire des maladies auto-immunes systémiques pour identifier de nouveaux bio-marqueurs pertinents

Financement : Innovative Medicines Initiatives (IMI), FP7, EC/EFPIA
Durée : 5 ans (2014-2019)
Partenariat : 28 partenaires, 12 pays
Budget global : 22,7M€
Budget LBAI : 834 400€
Site du projet
Le défi :
Les maladies auto-immunes systémiques, ‘systemic Autoimmune DiseaseS’ (SADS) sont un groupe de maladies inflammatoires chroniques dont les diagnostics sont difficiles à établir et les traitements aléatoires. Leur caractéristique commune est la présence d'auto-anticorps (dirigés contre des composants du Soi) dans le sérum. Trois maladies représentent principalement ces SADS: le lupus érythémateux disséminé, la polyarthrite rhumatoïde et la sclérodermie. Ces 3 maladies présentent des chevauchements importants dans leurs manifestations. Plusieurs autres entités et syndromes peuvent leur être associés comme le syndrome de Gougerot-Sjögren et le syndrome des anticorps antiphospholipides. Alors que chaque entité clinique peut être considérée comme « rare », l’ensemble constitue la troisième cause de morbidité de part le monde (1% de la population générale). En outre, il existe un grand nombre de personnes qui ne remplissent pas les critères cliniques ou qui ne partagent pas toutes les caractéristiques de l’une ou l’autre de ces maladies et qui de fait, vivent pendant des années comme des « cas indifférenciés ».
Les objectifs :
Le but de ce projet est d'utiliser la puissance des techniques dites « OMIQUES » (génomique, transcriptomique, épigénomique, métabolomique, protéomique), et la bioinformatique pour re-classifier ces maladies connues pour partager des mécanismes physiopathologiques communs. Cette approche « omique » n'a jamais été appliquée à l’échelle du patient, le privant des bénéfices potentiels de nouveaux agents thérapeutiques qui ne peuvent lui être proposé en raison des classifications cliniques actuelles. Notre hypothèse principale est que l'identification de signatures moléculaires spécifiques chez les patients atteints de SADS permettra aux cliniciens d'adapter leurs traitements. De fait, cela revient à mettre en œuvre des stratégies de médecine personnalisée.
Résultats attendus :
Les approches "omiques" associées à la bioinformatique intégrative devraient permettre : l'identification de biomarqueurs pour une utilisation clinique (diagnostic, pronostic, réponse aux traitements), l'identification de groupes de biomarqueurs qui caractérisent des groupes de patients (clustering), une classification des MAI basée sur les biomarqueurs cliniques pertinents, d'améliorer les connaissances scientifiques sur les interconnections existantes entre les MAI, de développer un protocole de prise en charge individualisé des patients souffrants de MAI.
En conclusion, les aspects contenus dans ce projet novateur et ambitieux contribueront à accroître la probabilité de succès de développer des nouveaux traitements et de proposer de nouvelles options thérapeutiques dans l'autoimmunité.
L'implication du LBAI :
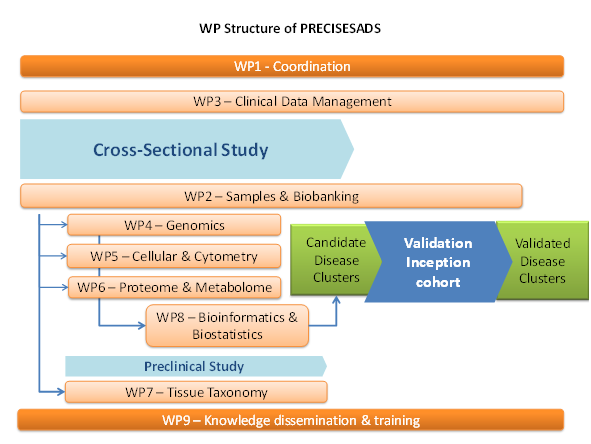
L'UMR 1227 était impliquée dans plusieurs lots de travaux (WPs) : WP1 “Coordination”, WP2 “Sample Collection and Biobanking”, WP3 “Clinical Data Management”, WP5 “Flow Cytometric Analysis and Cellular Separations from blood of patients with SADS and pre-clinical models” (WP leader: J.O. Pers), WP6 “Proteomics, Metabolomics and Serology of SADS”, WP8 “Data Analysis- Bioinformatics and Biostatistics” et WP9 “Knowledge Dissemination and Training”. Jacques-Olivier Pers était membre du comité de pilotage.
Papier princeps du projet :
Barturen G, Babaei S, Català-Moll F, Martínez-Bueno M, Makowska Z, Martorell-Marugán J, Carmona-Sáez P, Toro-Domínguez D, Carnero-Montoro E, Teruel M, Kerick M, Acosta-Herrera M, Le Lann L, Jamin C, Rodríguez-Ubreva J, García-Gómez A, Kageyama J, Buttgereit A, Hayat S, Mueller J, Lesche R, Hernandez-Fuentes M, Juarez M, Rowley T, White I, Marañón C, Gomes Anjos T, Varela N, Aguilar-Quesada R, Garrancho FJ, López-Berrio A, Rodriguez Maresca M, Navarro-Linares H, Almeida I, Azevedo N, Brandão M, Campar A, Faria R, Farinha F, Marinho A, Neves E, Tavares A, Vasconcelos C, Trombetta E, Montanelli G, Vigone B, Alvarez-Errico D, Li T, Blanco Alonso R, Corrales Martínez A, Genre F, López Mejías R, Gonzalez-Gay MA, Remuzgo S, Ubilla Garcia B, Cervera R, Espinosa G, Rodríguez-Pintó I, De Langhe E, Cremer J, Lories R, Belz D, Hunzelmann N, Baerlecken N, Kniesch K, Witte T, Lehner M, Stummvoll G, Zauner M, Aguirre-Zamorano MA, Barbarroja N, Castro-Villegas MC, Collantes-Estevez E, de Ramon E, Díaz Quintero I, Escudero-Contreras A, Fernández Roldán MC, Jiménez Gómez Y, Jiménez Moleón I, Lopez-Pedrera R, Ortega-Castro R, Ortego N, Raya E, Artusi C, Gerosa M, Luigi Meroni P, Schioppo T, De Groof A, Ducreux J, Lauwerys B, Maudoux AL, Cornec D, Devauchelle-Pensec V, Jousse-Joulin S, Jouve PE, Rouvière B, Saraux A, Simon Q, Alvarez M, Chizzolini C, Dufour A, Wynar D, Balog A, Bocskai M, Deák M, Dulic S, Kádár G, Kovács L, Cheng Q, Gerl V, Hiepe F, Khodadadi L, Thiel S, de Rinaldis E, Rao S, Benschop RJ, Chamberlain C, Dow ER, Ioannou Y, Laigle L, Marovac J, Wojcik J, Renaudineau Y, Borghi MO, Frostegård J, Martín J, Beretta L, Ballestar E, McDonald F, Pers JO, Alarcón-Riquelme ME. Integrative Analysis Reveals a Molecular Stratification of Systemic Autoimmune Diseases. Arthritis Rheumatol. 2020 Dec 8. doi: 10.1002/art.41610. Epub ahead of print. PMID: 33497037. https://onlinelibrary.wiley.com/doi/abs/10.1002/art.41610
Ce travail a été supporté par l'Initiative par l'Initiative Technologique Conjointe IMI, en vertu de l'accord de subvention n°115565. L'initiative conjointe était soutenue par le programme 7ème programme-cadre pour la recherche de l'Union européenne et par l'EFPIA.




